EPISTEME- 18
കാൻസർ നിവാരണവും ചികിൽസയും ഇന്നും ബാലികേറാമലയാണ്. പുതിയ കണക്കനുസരിച്ച് ഒരോ മിനുട്ടിലും 37 പേർക്ക് കാൻസർ സ്ഥിരീകരിക്കപ്പെടുന്നു, 19 പേർ മരിക്കുന്നു. അമേരിക്കയിൽ പ്രതിദിനം 5370 കാൻസർ കേസുകൾ ആശുപത്രികളിലെത്തുന്നു, 1670 പേർ പ്രതിദിനം മരിക്കുന്നു.
AI- ഉം Machine learning- ഉം വർദ്ധമാനമായ ഊർജ്ജത്തോടെയാണ് ഇതിനെ നേരിടാൻ തയാറെടുക്കുന്നത്. തന്മാത്രാപരമായി ‘രോഗങ്ങളുടെ ചക്രവർത്തി’യെ നേരിടാനാണ് AI യുദ്ധഭൂമിയിലിറങ്ങുന്നത്. പ്രത്യേക ജീനുകളെ തിരിച്ചറിഞ്ഞ് അവയെ വർഗ്ഗീകരിച്ച് സജീവമായവ, അതിസജീവമായവ, നിശ്ശബ്ദമായവ എന്നിങ്ങനെ തരം തിരിച്ച് കാൻസർ റ്റിഷ്യുവിലും സാധാരണ റ്റിഷ്യുവിലും ഇവ എങ്ങനെ വർത്തിക്കുന്നു എന്നതൊക്കെ നിശ്ചയിക്കുന്നത് ഇന്ന് AI തന്നെ.
കാൻസർ രോഗവിജ്ഞാനത്തിലെ (Oncology) പല ശാഖകളിലും Dataset- കൾ കൂടുതലായി ക്രോഡീകരിക്കപ്പെട്ടുവരുന്നുണ്ട്. കാരണം വിവരങ്ങൾ പലതും കമ്പ്യൂട്ടറിൽ ശേഖരിക്കപ്പെട്ടിട്ടുണ്ട്, അതിനുള്ള ഇടങ്ങളും വിപുലമാക്കപ്പെട്ടിട്ടുണ്ട്. വിഷമം പിടിച്ച ചോദ്യങ്ങൾക്ക് മറുപടി കിട്ടാൻ ഈ ‘ബിഗ് ഡേറ്റ’ വിശകലനം പര്യാപ്തമാകുന്നു എന്നത് വലിയ വാഗ്ദാനമാണ് നൽകുന്നത്. ‘Deep learning’ ഇവിടെ ഒരു ഉചിത ഉപകരണമാവുകയാണ്. നേരത്തെ അറിവില്ലാതിരുന്ന കോശ-തന്മാത്രാ വിന്യാസബന്ധങ്ങൾ ഇപ്പോൾ എളുപ്പം കണ്ടു പിടിയ്ക്കപ്പെടുകയാണ്. നേരത്തെ ഡയഗ്നോസ്റ്റിക് ചിത്രങ്ങളും ജീൻ പ്രവർത്തനങ്ങളുമായി ബന്ധിപ്പിക്കുന്ന പല അറിവുകളും കാൻസർ ചികിൽസയിൽ AI പ്രദാനം ചെയ്തിട്ടുണ്ട്.
ഇന്ന് കാൻസർ മേഖലയിൽ AI വളരെ സ്വാധീനം ചെലുത്തുന്നുണ്ട്: പ്രാരംഭ സൂചനകൾ, ഉചിതമായ രോഗനിർണയം, രോഗത്തിന്റെ ഭവിഷ്യത്തുകളെക്കുറിച്ചുള്ള മുൻകൂർ അറിവ്, കൃത്യതയാർന്ന മരുന്ന് നിർദ്ദേശം, (precision medicine), ഔഷധനിർമാണം, ഇലക്ട്രോണിക് മെഡിക്കൽ റെക്കോർഡുകൾ അനുസരിച്ച് ഔഷധം നിർമിച്ചെടുക്കൽ, റേഡിയോഗ്രാഫിക് ചിത്രങ്ങളുടെ വിശ്ലേഷണം, റ്റ്യൂമറിൽ ഓരോ ഇടത്തിലേയും കോശങ്ങളിലെ ജീൻ പ്രവർത്തനങ്ങൾ, വ്യത്യസ്ത കോശങ്ങളിലെ ഡി.എൻ.എയുടെ കണ്ണികളുടെ വിന്യാസം (DNA sequencing), ശരീരത്തിൽ ഘടിപ്പിക്കപ്പെടുന്ന സെൻസറുകൾ (wearable devices) നൽകുന്ന സമഗ്രവിവരങ്ങൾ ഇവയെല്ലാം ഒന്നിച്ച് പരിശോധിച്ച് പരസ്പരബന്ധം നിർവ്വചിച്ച്, കൃത്യമായ രോഗാവസ്ഥയും പരിചരണവും എ ഐ സാദ്ധ്യമാക്കുകയാണ്. വിചാരിച്ചിരിക്കാത്തതും മുൻകൂട്ടി പ്രവചിക്കാൻ സാദ്ധ്യതകളില്ലാത്തതുമായ നിഗമനങ്ങളിലാണ് എത്തപ്പെടുന്നത്. ഏറ്റവും വിദഗ്ദ്ധനായ ഡോക്ടർക്കുപോലും സാദ്ധ്യമല്ലാത്തതാണിത്.
പുതിയ കാൻസർ മരുന്നുകൾ കണ്ടുപിടിയ്ക്കാൻ AI യും Machine learning തന്ത്രങ്ങളും സഹായവുമായി വരികയാണിന്ന്.
രോഗനിരോധനവും പ്രാരംഭ കാൻസർ സ്ഥിരീകരണവും
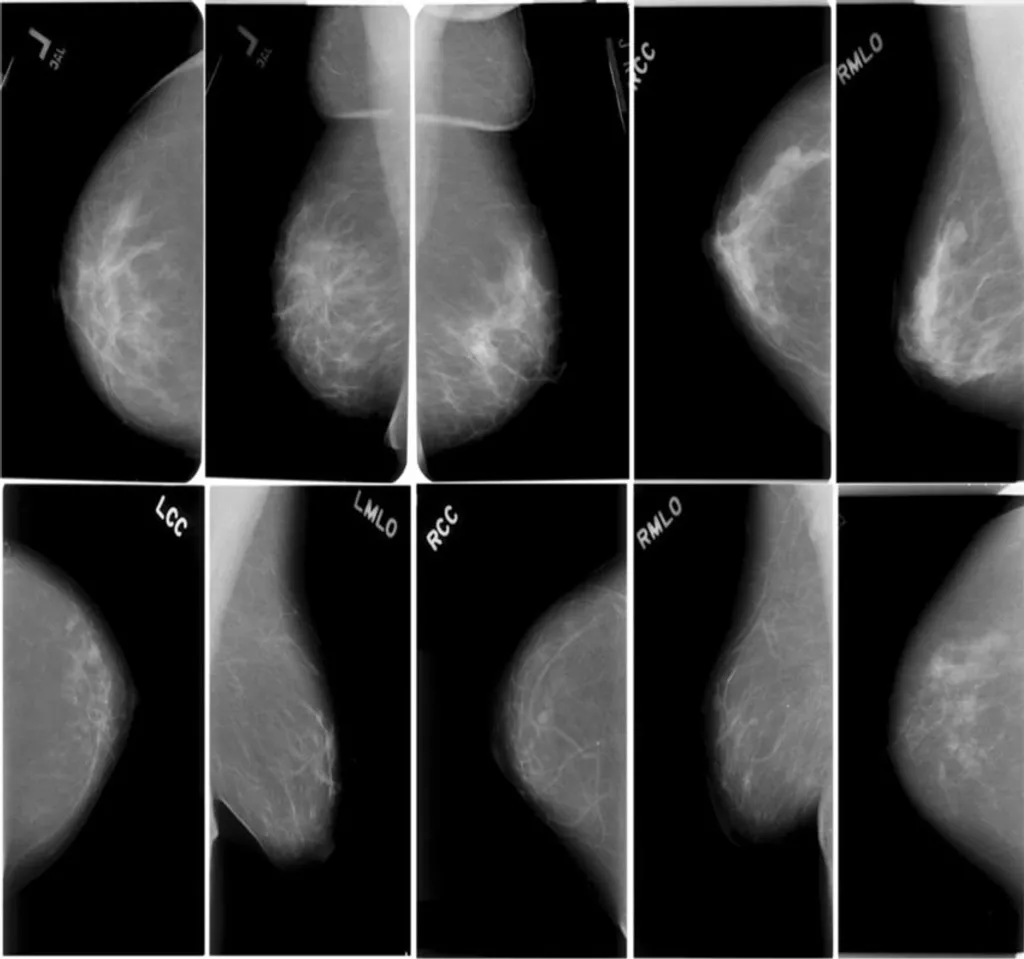
ശ്വാസകോശാർബുദത്തിന് വളരെ ലളിതമായ സി.ടി സ്കാനിങ് നിലവിലുണ്ട്, രോഗമുക്തിയ്ക്ക് ഇത് സഹായിക്കുന്നുമുണ്ട്. എങ്കിലും മറ്റ് കാൻസറുകൾക്ക് ഇതേ രീതി പിന്തുടരുന്നില്ല. 9496ഇന്ന് അന്തർദ്ദേശീയമായി ശ്വാസകോശാർബുദത്തിൻ്റെ സ്കാനിങ്ങ് വിശദാംശങ്ങൾ ശേഖരിക്കപ്പെട്ട ഡേറ്റാ സമാഹരണം നിർമിതബുദ്ധി വഴിയുള്ള വിശകലനങ്ങൾക്ക് ഇട നൽകുന്നു. I-ELCAP (International –Early Lung Cancer Action Program) സമാഹരിച്ചിട്ടുള്ളത് 3,00,000- ലേറെ സി.ടി സ്കാനിങ്ങ് വിശകലനങ്ങളും കാൻസർ ബാധിച്ചവരുടെ പങ്കാളിത്തത്തിൽനിന്ന് ലഭിക്കുന്ന 90,000-ലേറെ ദൈനംദിന വിവരങ്ങളുമാണ്.
1990 കൾ മുതൽ ഈ സംരംഭം AI ഉപയോഗിച്ച് ശ്വാസകോശാർബുദത്തിന്റെ സ്ഥിരീകരണവും ചികിൽസാമാർഗ്ഗങ്ങളും ചെയ്തുവരുന്നു. ഇതേ സി.ടി സ്കാനുകൾ ഉപയോഗിച്ച് ഹൃദ്രോഗങ്ങൾ, അസ്ഥിദ്രവീകരണാസുഖം (ഓസ്റ്റിയോപോറോസിസ്), ശ്വാസകോശനീർവീക്കം (എംഫസീമ) തുടങ്ങിയവയും സ്ഥിരീകരിക്കാൻ സാധിക്കുന്നുണ്ട്. ഇന്ന് ശ്വാസകോശാർബുദത്തിൻ്റെ സ്കാനിങ്ങ് ചിത്രങ്ങൾ പരിശോധിച്ച് നിഗമനങ്ങളിലെത്താൻ റേഡിയോളജിസ്റ്റിൻ്റെ ആവശ്യം ഇല്ലാതായിക്കൊണ്ടിരിക്കയാണ്.
അർബുദ പ്രോട്ടീനുകളെ ഉന്നം വെച്ചുള്ള ചികിൽസ (Oncoprotein –targeted therapy)
ഒരേ കാൻസർ ആണെങ്കിലും ഓരോ രോഗിയിലും ഡി.എൻ.എ. കണ്ണികളുടെ വിന്യാസവ്യത്യാസം (DNA sequence mutations) വ്യത്യാസപ്പെട്ടതായേക്കാം. പലപ്പോഴും ശ്വാസകോശാർബുദത്തിൽ EGF receptor എന്നൊരു പ്രോട്ടീനിനാണ് ഈ വിന്യാസവ്യത്യാസങ്ങൾ കാണാറ്. ഇത്തരം മ്യൂട്ടേഷനുകളെക്കുറിച്ച് വൻ വിവരസമാഹരണമാണ് നിലവിലുള്ളത്. ശ്വാസകോശത്തിൽ നിന്ന് എടുത്ത ടിഷ്യുവിൻ്റെ ഛേദങ്ങളുടെ ചിത്രങ്ങൾ (histology slides pictures) മാത്രം മതി ഇന്ന് ഡി.എൻ.എയിലുള്ള മ്യൂട്ടേഷനുകളെക്കുറിച്ച് അനുമാനിക്കാൻ. ഇപ്പോൾ ഈ വിവരശേഖരത്തിൽ ആയിരക്കണക്കിന് ഇത്തരം സ്ലൈഡുകളുടെ ചിത്രങ്ങളുണ്ട്. AI ആണ് ഈ രണ്ട് വിവരങ്ങളെ ബന്ധിപ്പിക്കുന്നത്.
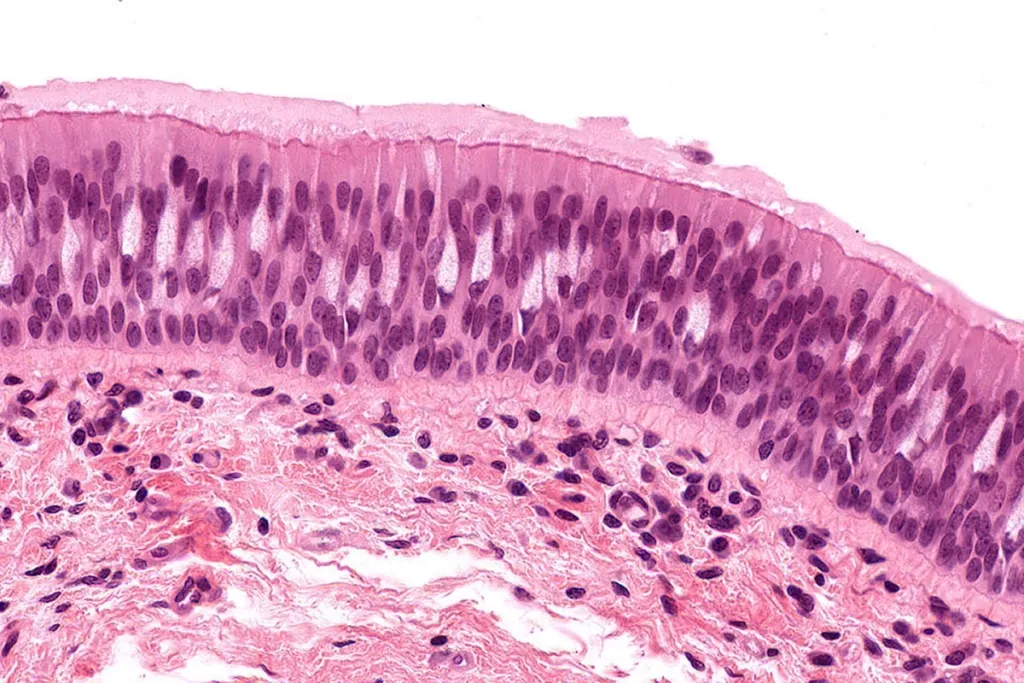
ഡി എൻ എ കണ്ണികളുടെ വിന്യാസങ്ങളറിയാൻ അതിസങ്കീർണമായ വിദ്യകൾ ആവശ്യമാണ്. പക്ഷേ ഈ സൗകര്യമില്ലാത്ത ലാബുകളിൽ ടിഷ്യു ഛേദങ്ങൾ മാത്രം നിർമിച്ചെടുത്താൽ ബാക്കി ജോലി AI തീർത്തുകൊള്ളും. കൃത്യമായി EGF receptor ൻ്റെ മ്യൂട്ടേഷന് എന്തു ചികിൽസയാണ് വേണ്ടതെന്നും എന്തായിരിക്കാം ഇനിയുള്ള ഭവിഷ്യത്തുകളെന്നും നിർമിതബുദ്ധി പറഞ്ഞു തരികയാണ്. ശ്വാസകോശത്തിലെ അഡെനോകാർസിനോമാ (Adenocarcinoma) ഇന്ന് പാശ്ചാത്യരാജ്യങ്ങളിൽ AI സഹായത്തോടെ എളുപ്പം നിർവ്വചിക്കപ്പെടുന്നു. EGF receptor- ൽ എന്ത് മ്യൂട്ടേഷനാണ് സംഭവിച്ചിട്ടുള്ളതെന്ന് അറിവു തരുന്നു, അതുവഴി ചികിൽസയിൽ കൃത്യത കൈവരുന്നു.
പ്രോട്ടീൻ മടക്കുകളിൽ ഏതൊക്കെ രാസവസ്തുക്കൾ ചെന്നിരിക്കാൻ സാദ്ധ്യതയുണ്ടെന്നുള്ളത് AI- modeling കാണിച്ചു തരും. ഇത് മനുഷ്യനാൽ സാദ്ധ്യമാകുന്നതല്ല.
കാൻസർ മരുന്ന് കണ്ടുപിടിക്കാൻ AI
പുതിയ കാൻസർ മരുന്നുകൾ കണ്ടുപിടിയ്ക്കാൻ AI യും Machine learning തന്ത്രങ്ങളും സഹായവുമായി വരികയാണിന്ന്. പ്രോട്ടീൻ നിർമിച്ചെടുക്കുന്നതിൻ്റേയും അവയുടെ ഘടനയും ആകൃതിയും പ്രവർത്തനവും തമ്മിൽ ബന്ധപ്പെടുത്തുന്നതിൻ്റേയും വിശദാംശങ്ങൾ വിദിതമാക്കാൻ പോന്നതാണ് Deep learning ആധാരമാക്കിയുള്ള പഠനങ്ങൾ. പ്രോട്ടീനുകൾ അമൈനോ ആസിഡ് കണ്ണികൾ കൊണ്ട് കൊരുത്ത നീണ്ട മാലകളാണ്. പക്ഷേ അവ പ്രവർത്തനനിരതമാകണമെങ്കിൽ പലതവണ മടക്കിച്ചുരുട്ടി പ്രത്യേക ത്രിമാന ആകൃതി കൈവരുത്തണം. അതിലെ മടക്കുകൾ വളരെ പ്രാധാന്യമർഹിക്കുന്നതാണ്. ഈ മടക്കുകളിലാണ് അവയെ ഉത്തേജിപ്പിക്കുന്നതോ നിർവ്വീര്യമക്കുന്നതോ ആയ രാസവസ്തുക്കൾ കയറിയിരിക്കുന്നത്. അമൈനോ ആസിഡുകളുടെ വിന്യാസമറിഞ്ഞാൽ ഈ ത്രിമാനാകൃതി നിർമിച്ചെടുക്കുന്നതിനെപ്പറ്റി ആവിഷ്ക്കാരങ്ങൾ സാദ്ധ്യമാണ്. ഇവിടെയാണ് AI യുടെ സാംഗത്യം. പ്രോട്ടീൻ മടക്കുകളിൽ ഏതൊക്കെ രാസവസ്തുക്കൾ ചെന്നിരിക്കാൻ സാദ്ധ്യതയുണ്ടെന്നുള്ളത് AI- modeling കാണിച്ചു തരും. ഇത് മനുഷ്യനാൽ സാദ്ധ്യമാകുന്നതല്ല.

‘കൈനേസ്’ (kinase) എന്ന വകുപ്പിൽപ്പെടുന്ന എൻസൈം പ്രോട്ടീനുകൾ കാൻസർ ഉളവാക്കുന്നതിൽ വൻ പങ്ക് വഹിക്കുന്നുണ്ട്. ഈ കൈനേസ് പ്രോട്ടീനുകളുടെ പ്രവർത്തനം തടയാൻ അവയുടെ മടക്കുകളെക്കുറിച്ചും അവയിൽ കൃത്യമായി കയറിയിരിയ്ക്കുന്ന രാസപദാർത്ഥങ്ങൾ ഏതൊക്കെയാണ് എന്നതിനെക്കുറിച്ചും “ആൽഫാ ഫോൾഡ്” (Alpha Fold) എന്ന AI-modeling പദ്ധതി വിവരങ്ങൾ പ്രദാനം ചെയ്തുകൊണ്ടിരിക്കയാണ്. ശ്വാസകോശാർബുദത്തിലെ മേൽച്ചൊന്ന EGF receptor ഒരു കൈനേസ് ആണ്, ഇതിൽ പറ്റിപ്പിടിയ്ക്കുന്ന പുതിയ മരുന്നുകൾ AI നിർദ്ദേശിക്കുന്നുണ്ട്, ഇപ്പോൾ. ഇതോടൊപ്പം machine learning ഈ കൈനേസുകളുടെ ആകൃതിയുടെ വർഗ്ഗീകരണവും മടക്കുകളുടെ പല സാദ്ധ്യതകളും അവയിൽ കയറാൻ തക്കവണ്ണം ആകൃതിസവിശേഷതയുള്ള രാസവസ്തുക്കൾ ഏതൊക്കെ എന്ന നിർദ്ദേശവും നൽകുന്നു, വിപ്ളവാത്മകമായി കാൻസർ ഡ്രഗ് ഡവലപ്മെന്റിനെ മുന്നോട്ട് നയിക്കുന്നു.
AI യും ഇമ്യൂണോ തെറാപ്പിയും
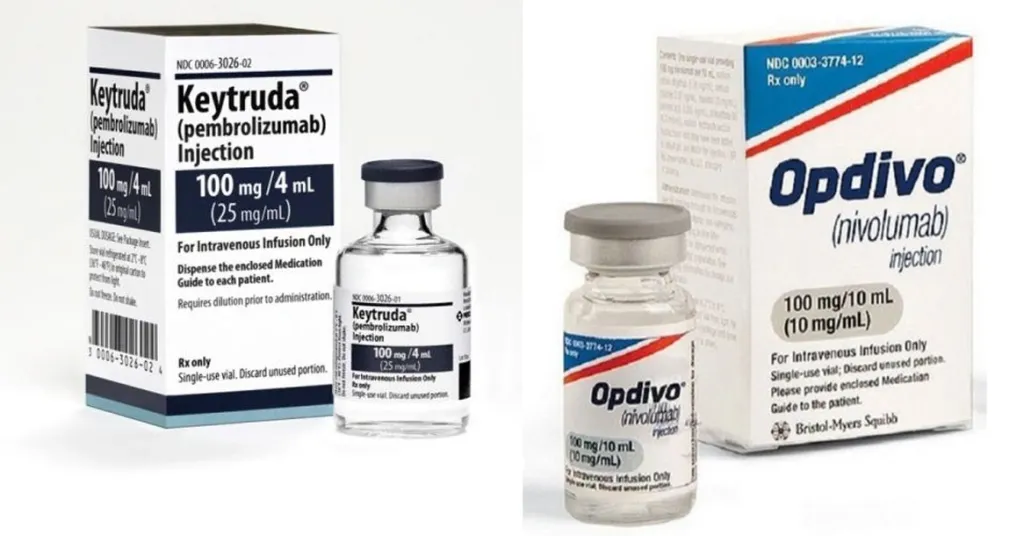
നമ്മുടെ പ്രതിരോധകോശങ്ങളെത്തന്നെ ഉപയോഗിച്ച് കാൻസർ കോശങ്ങളെ വകവരുത്തുന്ന തന്ത്രമാണ് ഇമ്യൂണോ തെറാപ്പി. പ്രതിരോധകോശങ്ങളിൽ നിന്ന് ഒളിച്ചുകളിക്കാൻ വശമുണ്ട് അർബുദകോശങ്ങൾക്ക്. കോശോപരിതലത്തിൽ ചില പ്രോട്ടീനുകൾ ഇണക്കി വെച്ചാണ് ഈ തന്ത്രശാലികൾ ഈ കർമം നിർവ്വഹിക്കുന്നത്. നമ്മുടെ പ്രതിരോധകോശങ്ങളെ തെറ്റിദ്ധരിപ്പിക്കുകയാണ് ഈ കാൻസർ കോശോപരിതല പ്രോട്ടീനുകൾ. നമ്മുടെ തന്നെ മര്യാദാകോശങ്ങളാണ് ഇവ എന്ന ധാരണ സൃഷ്ടിക്കപ്പെടുകയാണ് ഇപ്രകാരം. ഈ പ്രോട്ടീനുകളിന്മേൽ പറ്റിപ്പിടിച്ച് അവിടെ തടസ്സം സൃഷ്ടിച്ച് ഒളിച്ചുകളി അവസാനിപ്പിക്കുന്ന മരുന്നുകൾ ഇന്ന് ലഭ്യമാണ്. Keytruda, Opidivo ഒക്കെ ഇത്തരം ഇമ്യൂണോ തെറാപ്പി മരുന്നുകളാണ്.
എന്നാൽ റ്റ്യൂമറിൻ്റെ ചുറ്റുപാടും അതിസങ്കീർണ്ണമായ വലക്കണ്ണികളാണ്: കോശങ്ങൾ തമ്മിലും പ്രോട്ടീനുകൾ തമ്മിലും കോശങ്ങളും പ്രോട്ടീനുകളും തമ്മിലും സൃഷ്ടിക്കുന്ന ജഡിലത. മാത്രമല്ല ഒരു ട്യൂമറിൽത്തന്നെ കോശങ്ങൾ വൈവിദ്ധ്യമിയന്നതാണ്. വ്യത്യസ്ത ട്യൂമറുകളിലും ഈ കോശവിന്യാസങ്ങൾ വേറിട്ടതാകുന്നുണ്ട്. കൃത്യമായി പ്രതിരോധവ്യവസ്ഥകൾ അറിയാൻ പ്രയാസമാണെന്നർത്ഥം. ഇവിടെയാണ് AI സംഗതമാകുന്നത്. Machine learning, പ്രത്യേകിച്ചും deep learning തന്ത്രങ്ങൾ, ഇത്തരം കോശ / പ്രോട്ടീൻ ബന്ധങ്ങൾ വിശ്ലേഷണം ചെയ്യാനും അതിനെ ഇടവുമായി നിജപ്പെടുത്താനും (spatial placement) സാദ്ധ്യതകൾ പ്രവചിക്കാനും ആവിഷ്ക്കരിക്കപ്പെട്ടു വരുന്നുണ്ട്. മൂത്രാശയ കാൻസറിൽ ട്യൂമറിനു ചുറ്റുപാടും പ്രതീക്ഷിക്കപ്പെടാത്ത രീതിയിൽ പ്രതിരോധകോശങ്ങളും ട്യൂമർ കോശങ്ങളുമായുള്ള പരസ്പര വ്യവഹാരങ്ങൾ സംഭവിക്കുന്നു എന്ന് കണ്ടുപിടിച്ചിരിക്കുന്നു, ഈയിടെ. ഇമ്യൂണോ തെറാപ്പിയുടെ പ്രയോഗരീതികൾ നിജപ്പെടുത്താനും ഭവിഷ്യത്ത് അറിഞ്ഞിരിക്കാനും തെറാപ്പിയോട് ട്യൂമർ പ്രതികരിക്കുന്നതെങ്ങനെ എന്ന് നിരീക്ഷിക്കാനും deep learning ഉപയുക്തമാവുകയാണ്.
AI സഹായത്താൽ കരൾ കാൻസറും (Hepatocellular carcinoma) ഇന്ന് പുതിയ ഡയഗ്നോസിസും ചികിൽസാവിധികളും തേടുകയാണ്. മറ്റ് മരുന്നുകളോടൊപ്പം മേൽപ്പറഞ്ഞ ഇമ്യൂണോ തെറാപ്പി മരുന്നുകളും ഉപയോഗിക്കപ്പെടുന്നുണ്ട് എങ്കിലും ഏകദേശം 35% രോഗികൾക്കേ ഇത് ഫലപ്രദമാകുന്നുള്ളൂ. ചില പ്രത്യേക ജീനുകളുടെ അപഭ്രംശം കരൾ കാൻസറിന് കാരണമാകുന്നുണ്ട്. ഇത് പലരിലും വ്യത്യസ്തവുമായിരിക്കും. അതുകൊണ്ടാണ് ഒരേ അസുഖമാണെങ്കിലും ചിലരിൽ നിശ്ചിത ഇമ്യൂണോ തെറാപ്പി ഫലപ്രദമാകാതെ പോകുന്നത്.

ഏതു ജീനിനാണ് മ്യൂട്ടേഷൻ എന്നും അത് ഏതൊക്കെ നീർവീക്കത്തിനിടയാക്കുന്ന ജീനുകളെ ഉണർത്തിയെടുക്കുന്നു എന്നും AI കൃത്യമായി വിശകലനം ചെയ്ത് ചികിൽസ എളുപ്പമാക്കുന്നുണ്ട്. മേൽ സൂചിപ്പിച്ചതുപോലെ, ട്യൂമർ റ്റിഷ്യു ഛേദത്തിൻ്റെ ചിത്രങ്ങളിൽ (histopathology images) നിന്നുതന്നെ ഈ അനുമാനങ്ങൾ സാദ്ധ്യമാവുകയാണ്, ‘ബിഗ് ഡേറ്റ’ യിൽ ഇതിനുള്ള സാമഗ്രികളെല്ലാം അടങ്ങിയിരിക്കുന്നു എന്നതിനാൽ. ഇപ്പോൾ ഇമ്യൂണോ തെറാപ്പികളിൽ നിന്ന് വിവരങ്ങൾ ലഭിച്ചുകൊണ്ടിരിക്കയാണ്, താമസിയാതെ ഉചിതമായ ഇമ്യൂണോ തെറാപ്പി പദ്ധതികൾ deep learning വഴി നിർദ്ദേശിക്കപ്പെടാം എന്ന പ്രതീക്ഷയുണ്ട്.
ഇമ്യൂണോ തെറാപ്പിയിൽ അവസരോചിതമായ മാറ്റങ്ങൾ വരുത്തുന്നതിന് AI- യെ ആശ്രയിക്കേണ്ട രീതിയാണ് സംജാതമാകുന്നത്.
രക്താർബുദവും AI തന്ത്രങ്ങളും
രക്താർബുദത്തിൻ്റെ ഒരു വകഭേദമായ multiple myeloma- ക്ക് അതിനൂതനമായ ഇമ്യൂണോ തെറാപ്പി നിലവിൽ വന്നിട്ടുണ്ട്. രക്തത്തിൽ നിന്ന് ചില ശ്വേതകോശങ്ങളെ പുറത്തെടുത്ത് അവയെ കാൻസർ കോശങ്ങളെ നശിപ്പിക്കാനുതകുന്ന തരത്തിലുള്ളവയാക്കി മാറ്റി തിരിച്ച് രക്തത്തിൽ കുത്തിവെയ്ക്കുന്ന CAR-T തന്ത്രം ഇതിൽ പ്രധാനമാണ്. ഒളിച്ചുകളിയിലേർപ്പെടുന്ന കാൻസർ കോശങ്ങളെ കണ്ടുപിടിച്ച് നശിപ്പിക്കുന്നതാണ് ഈ വിദ്യയും. ഈ തന്ത്രത്തിനും ആൻ്റിബോഡികൾ ഉപയോഗിച്ചുള്ള മറ്റ് multiple myeloma ചികിൽസകൾക്കും ഇന്ന് AI ആക്കം കൂട്ടുന്നുണ്ട്. ആകപ്പാടെയുള്ള ജീനുകളുടെ (genome എന്ന് പേര്) വ്യത്യാസമനുസരിച്ച് ഈ അസുഖം തരം തിരിയ്ക്കപ്പെടുകയാണ്. ചികിൽസക്കുശേഷം രോഗം തിരിച്ചുവരാൻ സാദ്ധ്യതയുളവാക്കുന്ന ജീൻ മാറ്റങ്ങളേയും ഉൾക്കൊള്ളിച്ച് നിർമിതബുദ്ധി സ്വരൂപിച്ചെടുക്കുന്നത് പ്രായോഗികമായ ചികിൽസാപദ്ധതികളാണ്. മരുന്നുകൾക്ക് പുതിയ ഉപയോഗസംവിധാനങ്ങൾ കണ്ടുപിടിയ്ക്കുന്നതിനും വ്യക്തിപരമായി മരുന്നുകൾ മാറ്റി ഉപയോഗിക്കേണ്ടത്തിൻ്റെ പ്രയോഗവിധികൾ നിർദ്ദേശിക്കുന്നതിനും ഇമ്യൂണോ തെറാപ്പിയിൽ അവസരോചിതമായ മാറ്റങ്ങൾ വരുത്തുന്നതിനും AI- യെ ആശ്രയിക്കേണ്ട രീതിയാണ് സംജാതമാകുന്നത്.
ലഭിക്കുന്ന വിവരങ്ങൾ അനുസരിച്ച് AI യ്ക്കും മുൻകൂർ ധാരണകളുണ്ടായേക്കാം. ഉദാഹരണത്തിന്, പല പുതിയ മരുന്നുകളും പരീക്ഷിക്കപ്പെടുമ്പോൾ വെള്ളക്കാരിലാണ് അത് സംഭവിക്കുന്നത്, മറ്റ് വംശങ്ങൾ ഉൾപ്പെട്ടിരിക്കണമെന്നില്ല. ഇതിനെ തിരുത്തിയെടുക്കാൻ നിർമിതബുദ്ധിയെ പരിശീലിപ്പിക്കുന്ന രീതിയിലുള്ള ആവിഷ്ക്കാരങ്ങൾക്കുള്ള ഗവേഷണങ്ങൾ നടന്നു വരുന്നുണ്ട്. മരണത്തിനുള്ള സാദ്ധ്യതയെക്കുറിച്ചുള്ള പരാമർശങ്ങൾ ഇക്കാര്യത്തിൽ നിർണായകമാണ്. AI പദ്ധതികളിൽ മറ്റ് പല നൂതനത്വങ്ങളും കടന്നു വരുന്നുണ്ട്. ‘ഏകകോശ പഠനങ്ങൾ’ (single cell studies) -ഒരേ ഒരു കോശത്തിൻ്റെ മൊത്തം ജീൻ പ്രവൃത്തികളും ഫിസിയോളജിയും പഠിച്ചെടുക്കുന്ന പ്രക്രിയ-വിശ്ലേഷണം ചെയ്തടുക്കുമ്പോൾ വരുന്ന തെറ്റുകൾ ഒഴിവാക്കാൻ നിർമിതബുദ്ധി ഉപയോഗിക്കാമത്രെ. കാൻസറിൻ്റെ ആവിർഭാവവും അനുക്രമ പ്രഗതിയും സൂക്ഷ്മമായി വീക്ഷിക്കുന്നതിന് AI പിന്തുണ നൽകുമെന്നതും പ്രധാനമാണ്. Deep learning വിശ്ലേഷണം ചെയ്യുന്നത് സമഗ്രമായ വിവരശേഖരത്തെയാണ്. പ്രോട്ടീൻ സംബന്ധിയായ എല്ലാത്തിനേയും (Proteomics) ജീനുകൾ സംബന്ധിയായ എല്ലാത്തിനേയും (Genomics) എല്ലാ രോഗ / രോഗി വിവരങ്ങളേയും (Electronic medical records) ഉൾപ്പെടുത്തി മനുഷ്യസാദ്ധ്യമല്ലാത്ത അനുമാനനിർണയം നടത്തിയെടുക്കുകയാണ്. ഇത് ചികിൽസയുടെ പ്രതിക്രിയകളെക്കുറിച്ച് മുൻ കൂർ അറിവ് നൽകുകയാണ്. കാൻസർ പോലെ അതിസങ്കീർണമായ അസുഖത്തെ മനസ്സിലാക്കിയെടുക്കാനും കാൻസർ ആവിർഭാവസൂചനകൾ കണ്ടുപിടിക്കാനും വ്യക്തിഗതമായ ചികിൽസാപദ്ധതികൾ ആവിഷ്ക്കരിക്കുന്നതിനും ഇന്ന് വർദ്ധമാനമാകുന്ന, വൈവിദ്ധ്യമിയന്ന ‘ബിഗ് ഡേറ്റ’ യും AI യും കൈകോർക്കുമ്പോൾ പുതിയ വഴികൾ വെട്ടിത്തുറക്കപ്പെടുകയാണ്.
Reference:
1.Zhang, B., Shi, H. and Wang H. Machine learning and AI in cancer prognosis, prediction, and treatment selection: A critical approach. J. Multidisc. Healthcare 16:1779-1791, 2023.
2.Henschke, C., yankelevitz, D., Sidhom, J-W and Parsons, R. Advancing cancer research with artificial intelligence. In Frontiers of medical research: Artificial Intelligence. Science Special Edition, 2023.

